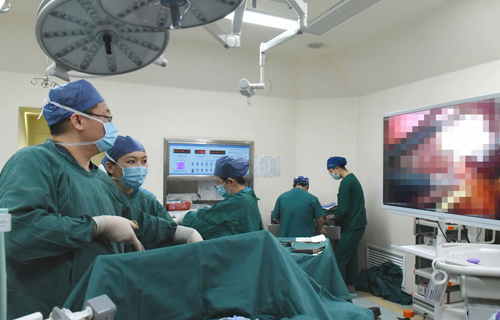
吉林省肝胆病医院药物临床试验机构办事指南
办事指南
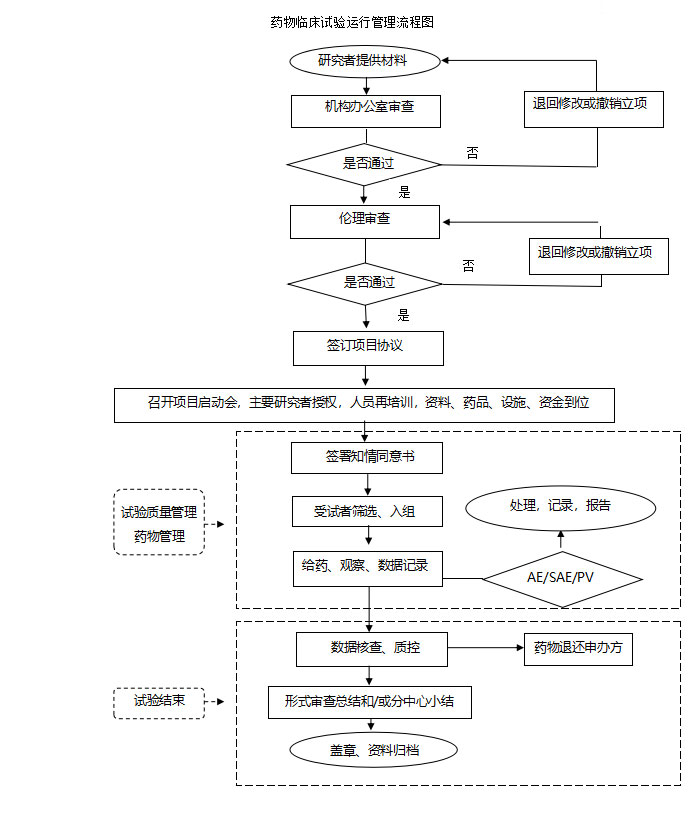
1.药物临床试验运行管理流程
2.临床试验项目受理与立项管理
●申办方或专业组负责人联系机构办公室,机构办公室根据专业组临床试验的现状,与专业组负责人共同评估是否同意受理该项药物临床试验。
●临床试验申请审查
1)专业组研究者到机构办公室领取或登录医院官网临床试验机构模块下载并填写《临床试验申请表》,主要研究者签名。
2)研究者根据“药物临床试验项目资料递交清单”,与申办方共同准备资料并递交机构办公室。机构办公室负责资料接收及形式审查:
3)办公室形式审查通过后,通过后给予受理号,《临床试验申请表》由机构办公室存档;
●临床试验项目通过临床试验伦理委员会审核同意后,研究者将伦理审查批件递交机构存档。机构办公室对临床试验项目进行立项。
●机构办公室负责临床试验合同的签订管理工作,具体参照《临床试验合同管理制度》;
3.临床试验结题
●机构确认试验用药品已退还申办方并完成交接。
●申办方完成项目稽查,并向机构办公室递交稽查报告。
●机构质量管理员对文件资料进行末次质量检查后,将纸质CRF第一、三联交申办者用于统计分析(电子CRF:申办方负责将电子数据刻盘后交于机构存档)。
●临床试验结束并完成数据答疑后2个月内,研究者将项目全部资料按照机构归档目录要求整理完善后交机构办公室。
●项目结题的审查意见经伦理委员会同意。
●机构审核总结报告和(或)分中心小结表中的内容与实际情况及统计报告中的内容一致,审核内容包括:研究单位名称,研究者情况,受试者入组、完成情况,本中心实验室正常值范围及不良事件记录。